
1.口服固体制剂、注射剂一致性评价服务
确定有关物质、异构体等方法,测定参比制剂和仿制制剂的有关物质、含量、异构体等;
稳定性研究;
处方工艺二次开发服务等。
2.包材相容性服务
3.生物等效性试验、药理毒理研究服务
新注册分类后的化药4类品种需要按照备案制的程序进行生物等效性研究;
在2007年前批准上市的化药仿制药,需要进行质量和疗效一致性评价,其中口服固体制剂需要按照备案制的程序进行生物等效性研究;
提供整套体内和体外非临床安全性评价方案等。
4.药物杂质分析
采集完整的LC-MS、GC-MS、IR、UV等数据,对分离出来的杂质进行结构鉴定;
API的强制氧化降解物的分离和结构鉴定;
用包括制备HPLC等技术分离监管起始原料,中间体,API和药物产品中的杂质;
采集完整的LC-MS数据,对分离出来的杂质进行结构鉴定;
API的强制氧化降解物的分离和结构鉴定;
多种色谱技术(HPLC, UPLC, GC等)和检测技术(UV, MS, MS/MS, IR, FID, ECD, ICP等),以满足不同类型的化合物检测。
5.方法开发和方法学验证
提供残留溶剂方法开发及验证(依照中国药典、美国药典、欧洲药典、ICH等要求);
提供基因毒性杂质的方法开发及验证(依照美国药典、欧洲药典、ICH等要求和客户的其它特殊要求)等。
6.目标物分离纯化
7.常规服务
8.制剂稳定性研究服务
储存条件:包括影响因素、加速和长期,或者客户制定的储存条件。
附录:
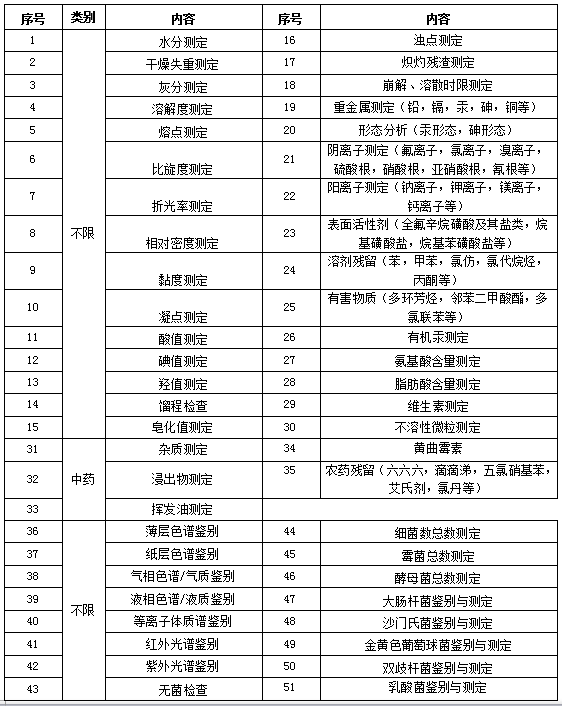
内容提供:联捷生物

